MSF reçoit une donation d’un médicament antituberculeux par le laboratoire Otsuka
Communiqué de presse
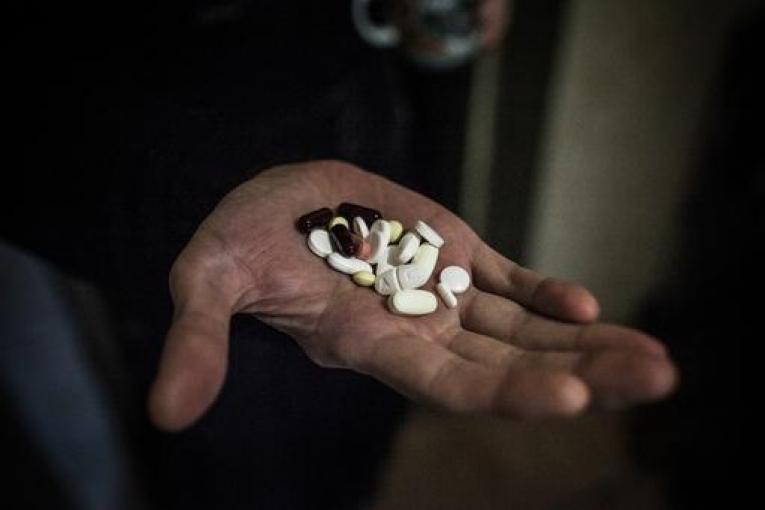
MSF exprime sa reconnaissance au laboratoire Otsuka pour la donation de 400 doses d’un nouveau médicament, le délamanide, qui va permettre à MSF et à ses partenaires de mettre sous traitement davantage de patients atteints de tuberculose multi-résistante (TB-MDR).
MSF n’accepte qu’exceptionnellement des donations, car elles ne représentent pas une solution pour améliorer le sort des patients atteints de TB dans le monde, et préfère plaider pour des conditions d’accès équitables aux médicaments.
En attendant qu’Otsuka détaille les conditions de commercialisation du délamanide, cette donation représente un moyen d’offrir un accès précoce au médicament à au moins une partie des quelque 40 000 personnes qui en auraient besoin.
Aujourd’hui, seuls 100 patients dans le monde ont pu avoir accès au délamanide, dans le cadre d’une utilisation dite ‘compassionnel’. Beaucoup d’entre eux ont pu recevoir le délamanide dans des programmes de traitement de la TB-DR gérés par MSF.
Certains de ces programmes font partie du projet endTB (Expand New Drugs Markets for Tuberculosis, ‘Elargir le marché des nouveaux médicaments antituberculeux’), un partenariat entre MSF, Partners in Health (PIH), Interactive Research and Development (IRD) et UNITAID, partenaire financier.
« Ces dernières années nous avons donné accès au délamanide à un nombre limité de patients qui n’avaient plus d’options thérapeutiques disponibles, explique le Dr. Francis Varaine, coordinateur du groupe international de travail de MSF contre la tuberculose et du projet endTB. Cette donation va nous permettre de traiter davantage de patients avec le délamanide, et surtout de le faire à un stade plus précoce de leur maladie ».
A travers le projet endTB, un nombre plus conséquent de patients va recevoir le délamanide, dans le cadre d’une étude observationnelle de leur traitement.
Le projet va respecter les protocoles d’utilisation de ce médicament définis par l’Organisation Mondiale de la Santé, le délamanide n’ayant pas encore complété son parcours de développement clinique.
En plus de MSF, PIH et IRD, partenaires du projet endTB, d’autres projets MSF de prise en charge de la TB-DR, auront accès au délamanide à travers cette donation.
« Nous allons continuer de demander un accès rapide et élargi au délamanide, pour que l’on puisse fournir des traitements plus efficaces contre la TB résistante à l’avenir, poursuit le Dr. Varaine. La priorité doit être l’intérêt des patients. Ceci doit se traduire par l’accélération de l’utilisation des nouveaux médicaments antituberculeux dans les pays où la TB-DR est le plus répandue, et où le manque d’accès reste un problème majeur ».
A propos du partenariat endTB
Le projet endTB (Expand New Drugs Markets for Tuberculosis, ‘Elargir le marché des nouveaux médicaments antituberculeux’) vise à développer de nouveaux traitements pour la TB-MDR, plus courts, moins toxiques et plus efficaces. Le projet, d’une durée de 4 ans, est financé à hauteur de 60,4 millions de dollars par UNITAID.
Au moins 2 600 patients recevront un des deux nouveaux médicaments antituberculeux (bédaquiline ou délamanide) dans 15 pays : Arménie, Bangladesh, Biélorussie, Corée du Nord, Ethiopie, Géorgie, Kazakhstan, Kenya, Kirghizistan, Indonésie, Lesotho, Myanmar, Népal, Pakistan et Pérou. Chaque patient fera l’objet d’un suivi de l’efficacité du traitement et d’éventuels effets secondaires.
Des essais cliniques seront également menés dans cinq sites (en Géorgie, au Kazakhstan, au Kirghizistan, au Lesotho et au Pérou), qui étudieront la sécurité et l’efficacité de plusieurs traitements ‘simplifiés’ contre la TB-MDR, chacun contenant une nouvelle molécule.
Le projet vise également à réduire les barrières existantes au niveau des pays vers une utilisation plus large des nouveaux médicaments antituberculeux. endTB va créer davantage d’éléments cliniques permettant de faciliter leur enregistrement dans les pays, ainsi que des éléments supplémentaires pouvant faire évoluer les recommandations de l’OMS en matière d’utilisation de la bédaquiline et du délamanide.
Le projet endTBva également plaider pour des mécanismes d’approvisionnement plus simples et rapides pour ces nouveaux médicaments.


